Es gibt mehrere häufige Gründe, warum ein Medikament zurückgerufen werden kann: Kontamination, unterschiedliche Potenzgrade, falsche Etikettierung oder fehlende Wirksamkeit. Dann gibt es Medikamente, die zurückgerufen werden, weil die Nebenwirkungen so höllisch sind, es ist einfach falsch, das Medikament auf dem Markt zu halten. Wir denken gerne, wenn die Regierung etwas über die Food and Drug Administration (FDA) genehmigt, dass es sicher ist und gründlich erforscht und studiert wurde und alle möglichen Nebenwirkungen bekannt sind, aber das ist einfach nicht der Fall. Dies beweisend, hier sind 25 vielversprechende Medikamente, die von der FDA zugelassen wurden, aber später zurückgerufen wurden.
Eigenschaft-Bild: Shutterstock
Diethylstilbestrol
 Quelle: http://247wallst.com/
Quelle: http://247wallst.com/ Auch bekannt als DES, wurde dieses Medikament im Jahr 1975 nach fast vierzig Jahren auf dem Markt zurückgerufen. Eine Droge, die eine Fehlgeburt verhindern sollte, wurde Jahre später bei den Frauen, deren Mütter sie während der Schwangerschaft eingenommen hatten, zu Tumoren in den Töchtern geführt. Es ist immer noch manchmal Männern verschrieben, Östrogen-Mangel zu behandeln.
Cylert
 Quelle: http://prescriptiondrugs.procon.org/
Quelle: http://prescriptiondrugs.procon.org/ Cylert war eine Droge, die das zentrale Nervensystem beeinflusste und wurde verwendet, um ADS / ADHS zu behandeln. Es war 35 Jahre auf dem Markt, bevor es 2010 gezogen wurde, weil es Leberschäden verursachte.
Dextropropoxyphen
 Quelle: https://en.wikipedia.org
Quelle: https://en.wikipedia.org Dieses Medikament wurde als mildes Schmerzmittel und manchmal als Hustenmittel verwendet. Es hatte auch leichte lokalanästhetische Wirkungen. Es wurde 2010 in den USA und 2009 aufgrund von Herzrhythmusstörungen und tödlichen Überdosierungen vom Markt genommen.
Darvon und Darvocet
 Quelle: http://www.webmd.com/
Quelle: http://www.webmd.com/ Nachdem Darvon & Darvocet über ein halbes Jahrhundert auf dem Markt waren, wurden sie 2010 in den USA verboten, sechs Jahre nachdem sie in Großbritannien verboten wurden. Insbesondere wurde der Inhaltsstoff Propoxyphen aufgrund von Herz-Nebenwirkungen wie tödlichen abnormalen Rhythmen bei ansonsten gesunden Patienten, die die Medikamente wie angewiesen einnehmen, verboten.
Cerivastatin (Baycol)
 Quelle: http://247wallst.com/
Quelle: http://247wallst.com/ Cerivastatin (auch bekannt als Baycol) wurde nach nur vier Jahren auf dem Markt im Jahr 2001 zurückgerufen. Vorgeschlagen, um hohe Cholesterinwerte zu behandeln, verursachte es schwere Nieren- und Muskelprobleme und ist verantwortlich für mindestens 52 Todesfälle.
Bromfenac (Durakt)
 Quelle: http://prescriptiondrugs.procon.org/
Quelle: http://prescriptiondrugs.procon.org/ Bromfenac (auch bekannt als Duract) war ein nicht-steroidale entzündungshemmende Medikament (oder NSAID), die 1998 nach nur einem Jahr vom Markt gezogen wurde, weil trotz Anweisungen eindeutig nur für zehn Tage oder weniger zu verwenden, nahmen Menschen es für mehr als zehn Tage, und es verursachte schwere Leberschäden, die in den gleichen Fällen Transplantation erforderten oder zum Tod führten.
Lotronex (Alosetron)
 QuelleLhttp: //www.nytimes.com/
QuelleLhttp: //www.nytimes.com/ Lotronex (auch bekannt als Alosetron) wurde auf den Markt gebracht und im selben Jahr 2000 zurückgerufen. Ein Medikament, das zur Behandlung des Reizdarmsyndroms eingesetzt wurde, Lotronex hat auch einige wichtige Nebenwirkungen wie Darmentzündung und Verletzung und führte zu 5 Todesfällen. Das Interessante an Lotronex ist, dass Patienten, denen das Medikament sehr geholfen hatte, sich lautstark bei der FDA über den Rückruf beschwerten, da viele von ihnen keine Nebenwirkungen hatten. Aus diesem Grund wurde das Medikament im Jahr 2002 mit eingeschränkter Nutzung und mehr Patientenbeobachtung wieder eingeführt.
Pergolid
 Quelle: https://en.wikipedia.org
Quelle: https://en.wikipedia.org Dieses Medikament, auch bekannt als Permax und Prascend, war ein Medikament zur Behandlung von Parkinson-Patienten und war fast zwei Jahrzehnte auf dem Markt, bevor es im Jahr 2007 aufgrund einer Schädigung der Herzklappen zurückgerufen wurde. Es ist jedoch immer noch verfügbar, Cushing-Krankheit bei Pferden zu behandeln. Einige Patienten in Australien, die die Droge nahmen, behaupteten, dass es Spielsucht und Sexsucht verursachte (was tatsächlich möglich ist, wenn man bedenkt, dass es an Dopaminrezeptoren im Gehirn arbeitete).
Encainide (Enkaid)
 Quelle: http://ahrp.org/
Quelle: http://ahrp.org/ Encainide (auch als Enkaid bekannt) wurde zur Behandlung unregelmäßiger Herzrhythmen verwendet, wurde aber 1991 aufgrund von proarrhythmischen Nebenwirkungen vom Markt genommen. Dies ist eine phantastische Art zu sagen, dass die Medizin zur Behandlung abnormaler Herzrhythmen verwendet wird. abnorme Rhythmen des Herzens.
Mylotarg
 Quelle: http://www.fda.gov/
Quelle: http://www.fda.gov/ Lukämie-Behandlung Mylotarg wurde vom Hersteller Pfizer freiwillig auf Antrag der FDA nach einem Jahrzehnt auf dem Markt zurückgerufen, da in Studien, in denen Mylotarg zu Chemotherapie-Behandlungen hinzugefügt wurde, keine Verbesserung gezeigt wurde und die Patientengruppen, die Mylotarg erhielten, eine höhere Zahl aufwiesen des Todes.
Propulsid (Cisaprid)
 Quelle: https://en.wikipedia.org
Quelle: https://en.wikipedia.org Propulsid (auch bekannt als Cisaprid) wurde verwendet, um GERD zu behandeln und zog im Jahr 2000 nach weniger als zehn Jahren auf dem Markt aufgrund schwerer Herzrhythmusstörungen aus dem Markt.
Vioxx
 Quelle: http: //prescriptiondrugs.procon.org/
Quelle: http: //prescriptiondrugs.procon.org/ Vioxx wurde 2004 nach 5 Jahren auf dem Markt als NSAID zurückgerufen. Es war mit über 27.000 plötzlichen Herzstillstand oder Herz-Tod verbunden.
Terfenadin (Seldane)
 Quelle: http: //247wallst.com/ Bildquelle: pixabay.com (public domain)
Quelle: http: //247wallst.com/ Bildquelle: pixabay.com (public domain) Terfenadin (auch bekannt als Seldane) wurde 1997 nach 13 Jahren auf dem Markt zurückgerufen. Es war eine nicht schläfrige Allergie Droge, die leider Herzrhythmusstörungen verursachte, wenn sie mit anderen Drogen genommen wurde. Über 100 Millionen Menschen nutzten Terfenadine zum Zeitpunkt des Rückrufs und machten es zu einem der größten Rückrufe auf dieser Liste. Aventis, die Firma, die das Medikament herstellte, führte bald danach Allerga ein.
Bextra (Valdecoxib)
 Quelle: http://www.drugsdb.com/
Quelle: http://www.drugsdb.com/ Bextra (auch bekannt als Valdecoxib) war ein NSAID zur Behandlung von Arthritis, entwickelt, um weniger Magen Nebenwirkungen zu haben. Es wurde im Jahr 2005 gezogen, nach einer großen Anzahl von Klagen, weil seine Nutzer mehr als doppelt so häufig Blutgerinnsel, Schlaganfall, Herzinfarkte und eine tödliche Hauterkrankung erleben.
DBI (Phenformin)
 Quelle: http://prescriptiondrugs.procon.org/
Quelle: http://prescriptiondrugs.procon.org/ DBI (auch bekannt als Phenformin) war ein Antidiabetikum, das fast zwei Jahrzehnte auf dem Markt war, bevor es in den späten 70er Jahren gezogen wurde. Es verursachte eine Anhäufung von Milchsäure und niedrigem pH-Wert in Geweben von Patienten, die das Medikament einnahmen.
Rapacuronium (Raplon)
 Quelle: https://en.wikipedia.org
Quelle: https://en.wikipedia.org Rapacuronium (auch bekannt als Raplon) war ein Medikament, das während der allgemeinen Anästhesie verwendet wurde, um die Inkubation zu unterstützen. Es wurde im Jahr 2001 nach weniger als zwei Jahren auf dem Markt wegen des Risikos der tödlichen Bronchialinfektion im Zusammenhang mit der Verwendung des Medikaments zurückgezogen.
FEN-PHEN
 Quelle: http://www.drugsdb.com/
Quelle: http://www.drugsdb.com/ FEN-PHEN (auch bekannt als Fenfluramin / Dexfenfluramin und Phentermin) war eine Kombination Gewichtsverlust Medikament, und es arbeitete Berichten zufolge sehr gut. Leider verursachte es auch Herzklappenprobleme und manchmal Tod bei den Frauen, die es nahmen.
Mibefradil (Posicor)
 Quelle: http://247wallst.com/
Quelle: http://247wallst.com/ Mibefradil (auch bekannt als Posicor) wurde 1998 nach nur einem Jahr auf dem Markt zurückgerufen, nachdem es mit 123 Todesfällen in Verbindung gebracht worden war. Beabsichtigt, Bluthochdruck und Angina zu behandeln, hatte Posicor tödliche Interaktionen, wenn sie mit anderen, üblichen Rauschgiften kombiniert wurden.
Zelmid
 Quelle: http://ahrp.org/
Quelle: http://ahrp.org/ Zelmid war ein Antidepressivum, das 1982 sowohl von der FDA als auch von der FDA zugelassen wurde. Die FDA hat dieses Medikament buchstäblich genommen, bevor es den Markt erreichte, weil es tatsächlich ein höheres Suizidrisiko verursachte. Danke FDA, aber auch, wie wurde das in erster Linie genehmigt, FDA?
Trasylol
 Quelle: http://prescriptiondrugs.procon.org/
Quelle: http://prescriptiondrugs.procon.org/ Trasylol kam erstmals in den 60er Jahren auf den Markt und wurde 2008 vom Markt genommen. Es wurde verwendet, um den Blutverlust während der Operation zu reduzieren, hatte aber schwerwiegende Nebenwirkungen wie Nierenschäden, Herzversagen, Schlaganfälle und ein erhöhtes Todesrisiko.
Selacryn
 Quelle: http://www.nytimes.com/
Quelle: http://www.nytimes.com/ Selacryn war ein Blutdruckmedikament, das in den frühen 80er Jahren nach weniger als einem Jahrzehnt auf den Markt gebracht wurde, aufgrund von Hepatitis, über 30 Todesfällen und Hunderten von Fällen von schweren Nieren- und Leberschäden. SmithKline, der Hersteller des Medikaments, bekannte sich vor Gericht schuldig, die bekannten Nebenwirkungen nicht an die FDA weitergegeben zu haben, um das Medikament auf den Markt zu bringen. Schande über sie.
Wenn Sie diese Liste genossen haben, schauen Sie sich 25 Neugierige Fakten über Cannabis die meisten Menschen nicht erkennen.
Quaalude
 Quelle: http://ahrp.org/
Quelle: http://ahrp.org/ Quaalude, das unter vielen verschiedenen Namen vermarktet wurde und manchmal als Date-Rape-Medikament verwendet wurde, ist ein Beruhigungsmittel und wurde 1985 aufgrund von Spaß-Nebenwirkungen wie Manie, Krampfanfällen und Tod vom Markt genommen. Es ist jetzt als eine Schedule I Droge in den USA aufgeführt, wie LSD und Heroine, was bedeutet, dass keine Rezepte dafür geschrieben werden können, und die FDA glaubt, dass das Medikament wenig bis keinen therapeutischen Wert hat.
Meridia (Sibutramin)
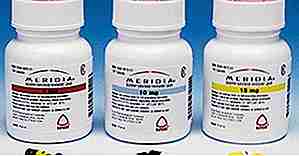 Quelle: http://www.fda.gov/
Quelle: http://www.fda.gov/ Meridia (auch bekannt als Sibutramin) war ein appetitzügelndes Medikament zur Behandlung von Fettleibigkeit, das 13 Jahre auf dem Markt war, bevor es 2010 aufgrund eines erhöhten Herzinfarkts und Schlaganfallrisikos gezogen wurde. Sie wissen, .. die gleichen Dinge, die Fettleibigkeit setzt Sie für ein höheres Risiko für.
Hismanal (Astemizol)
 Quelle: http: //prescriptiondrugs.procon.org/
Quelle: http: //prescriptiondrugs.procon.org/ Hismanal, ein Antiphyktikum (auch bekannt als Astemizol), wurde 1999 nach über einem Jahrzehnt wegen seiner Wirkung auf die Kaliumkanäle im Herzen vom US-Markt genommen.
Accutane
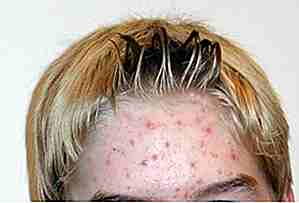 Quelle: http://prescriptiondrugs.procon.org/ Bildquelle: commons.wikimedia.org (public domain)
Quelle: http://prescriptiondrugs.procon.org/ Bildquelle: commons.wikimedia.org (public domain) Accutane (eine Form von Vitamin A) war eine sehr beliebte Akne-Droge für fast dreißig Jahre, bevor es im Jahr 2009 vom Markt gezogen wurde aufgrund von Nebenwirkungen wie: Selbstmordentlassungen, Reizdarm-Syndrom und eine ganze Reihe von Problemen für Frauen, die später schwanger wurde wie Fehlgeburt, Frühgeburt und schwere Geburtsfehler. Es gibt jedoch generische Marken der Medikamente, die überraschend noch auf dem Markt verfügbar sind.
Fotos: 25. DES Tochter über Flickr, 24. Cylert Infoblatt (Fair Use), 23. Proexvil (mit Dextropropoxyphen - fair use - Demonstrative Zwecke), 22. Darvocet (faire Verwendung), 21. BruceBlaus über Wikimedia Commons, 20 BruceBlaus über wikimedia commons, 19. Lotronex Infoblatt (fair use), 18. Pergolide (fair use), 17. Encainide (faire Verwendung), 16. Mylotarg (fair use), 15. Propulsid (fair use), 14. David Jordan über Wikimedia Commons, 12. Bextra (faire Verwendung), 11. Phenformin (faire Verwendung), 10. Raplon (faire Verwendung), 9. FEN-PHEN (faire Verwendung), 8. Ian Fürst über Wikimedia Commons, 7. Sander van der Wel über Flickr, 6. Trasylol (faire Nutzung), 5. www.volganet.ru über Wikimedia Commons, 4. Quaalude (faire Nutzung), 3. Meridia (faire Nutzung), 2. Hismanal (fair use)




